Wprowadzenie
Waskulopatia prążkowiowo-wzgórzowa (ang. lenticulostriated vasculopathy; LSV) jest sporadycznie obserwowanym w badaniu usg mózgowia objawem związanym z hiperechogenicznym obrazem naczyń wzgórzowo-prążkowiowych i soczewkowo-prążkowiowych. W dosłownym tłumaczeniu nazwa polska powinna brzmieć „waskulopatia soczewkowo-prążkowiowa”. Nie ma jednak polskiego tłumaczenia tej nazwy uznanego za powszechnie obowiązujące. W polskim piśmiennictwie jest też stosowane określenie 'vaskulopatia lenticulostriata’ oraz 'waskulopatia naczyń wzgórzowych’, a także skrót LSV. W portalu eduson.pl zastosowano najpopularniejszą (zdaniem autorów) polską nazwę tego objawu. Według różnych źródeł LSV występuje w badaniu usg u wcześniaków i noworodów donoszonych z częstością 0,4 – 5,8%. Jako, że pojęcie waskulopatii prążkowiowo-wzgórzowej, pojawiające się w opisach usg mózgowia noworodków i niemowląt, stanowi często duże wyzwanie dla klinicystów niezwiązanych z diagnostyką usg, podejmujemy próbę wytłumaczenia tego objawu i jego klinicznego znaczenia.
Obraz ultrasonograficzny
Pierwsze opisy waskulopatii prążkowiowo-wzgórzowej w badaniu ultrasonograficznym pochodzą z lat osiemdziesiątych ubiegłego wieku. Uważa się, że Grant w 1985 roku jako pierwszy, opisując podwyściółkowe 'krzaczkowate’ zwapnienia, dość trafnie zobrazował LSV u noworodków z wrodzonymi infekcjami z grupy TORCH, łącznie z innymi zmianami: zwapnieniami podwyściółkowymi i jamami malacyjnymi.
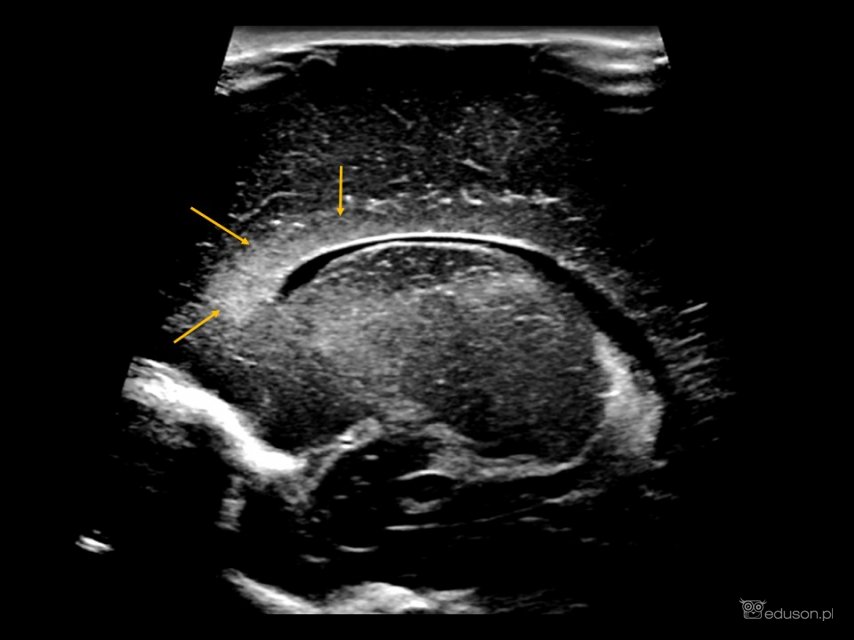
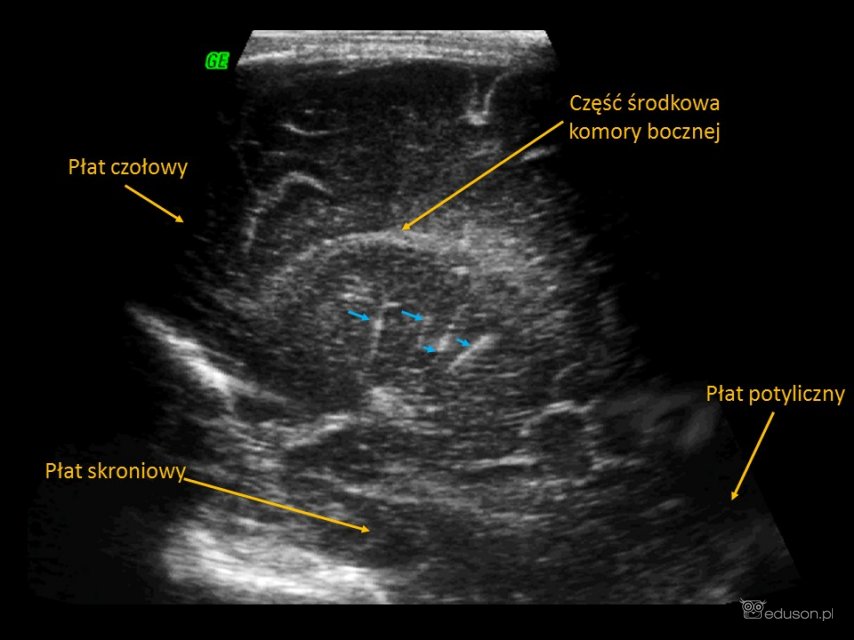
Waskulopatia prążkowiowo-wzgórzowa widoczna jest w obrazach ultrasonograficznych jako hiperechogeniczne, linijne pasma promieniście rozchodzące się w okolicy wzgórz i jąder podstawy. Te hiperechogeniczne pasma odpowiadają zmienionym przez patologiczne procesy ścianom naczyń wzgórzowo-prążkowiowych i soczewkowo-prążkowiowych.
Waskulopatia prążkowiowo-wzgórzowa o miernym nasileniu. Przekrój podłużny przystrzałkowy. Głowica liniowa.
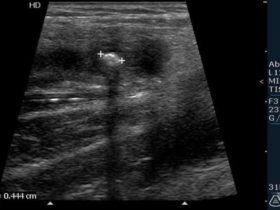
W prawidłowych obrazach ultrasonograficznych zazwyczaj nie udaje się uwidocznić ścian naczyń wzgórzowo-prążkowiowych i soczewkowo-prążkowiowych. Przepływ w tych naczyniach jest widoczny w opcjach dopplerowskich (zwłaszcza przy zastosowaniu dopplera mocy).
Hiperechogeniczne pasma, odpowiadające LSV, nie są, wbrew powszechnym opiniom, linijnymi zwapnieniami. W dostępnym piśmiennictwie podkreśla się złożoność procesów patofizjologicznych prowadzących do powstania zmian charakterystycznych dla LSV. W większości badań histopatologicznych opisywane są cechy uszkodzenia ściany naczynia krwionośnego z obecnymi w ścianie i wokół niej złogami żelaza i materiałem zasadochłonnym. Towarzyszą temu cechy przerostu ściany naczynia, ale bez jej włóknienia. Tylko w nielicznych publikacjach opisuje się cechy mineralizacji ściany naczyń z obecnością złogów wapnia. Możliwe, że różnorodny obraz histopatologiczny związany jest z różnymi etapami rozwoju waskulopatii.
Naczynia wzgórzowo-prążkowiowe w opcji dopplera mocy.
Wielu autorów podkreśla, że waskulopatia prążkowiowo-wzgórzowo w większości przypadków jest lepiej widoczna w badaniu ultrasonograficznym, w porównaniu z badaniem TK i MRI mózgowia. Dlatego badanie usg uważa się za najlepszą metodę monitorowania LSV. Cechy waskulopatii prążkowiowo-wzgórzowej najczęściej widoczne są symetrycznie, w obu półkulach mózgu, choć znane są opisy jednostronnego występowania tego objawu. Również stopień nasilenia LSV może być różny – od bardzo słabo wyrażonych cech LSV, do nasilonych zmian z objawem artefaktu migotania (w opcji kolorowego dopplera) świadczącym o obecności złogów wapnia w świetle naczyń.
Waskulopatia prążkowiowo-wzgórzowa (LSV) w badaniu usg mózgowia u noworodka. Zmienione (hiperechogeniczne) naczynia zaznaczono niebieskimi strzałkami.
Nie ma reguły co do progresji i regresji waskulopatii prążkowiowo-wzgórzowej. W większości przypadków obserwuje się stopniowe ustępowanie cech LSV w badaniu usg wraz z wiekiem pacjenta. Jednak w pewnych grupach pacjentów obserwuje się utrzymywanie tego objawu lub też jego nasilenie.
Znaczenie kliniczne
W dostępnym piśmiennictwie podkreśla się wieloczynnikową etiologię waskulopatii prążkowiowo-wzgórzowej, przy czym nie udało się jednoznacznie określić klinicznego znaczenia tych zmian. Uważa się, że zmiany o charakterze LSV częściej występują w przebiegu infekcji wrodzonych z grupy TORCH, a także u dzieci z wrodzonymi wadami serca, wadami genetycznymi (głównie aberracje chromosomalne) oraz w przebiegu chorób metabolicznych i wtórnych zaburzeń metabolicznych (np. alkoholizm i narkomania u matki). Wielu autorów za niezależny czynnik sprzyjający LSV uważa niedotlenienie okołoporodowe. W około 20% przypadków nie udaje się ustalić przyczyny waskulopatii. Waskulopatia prążkowiowo-wzgórzowa występuje częściej w populacji dzieci wymagającej intensywnej opieki okołoporodowej w porównaniu z noworodkami zdrowymi.
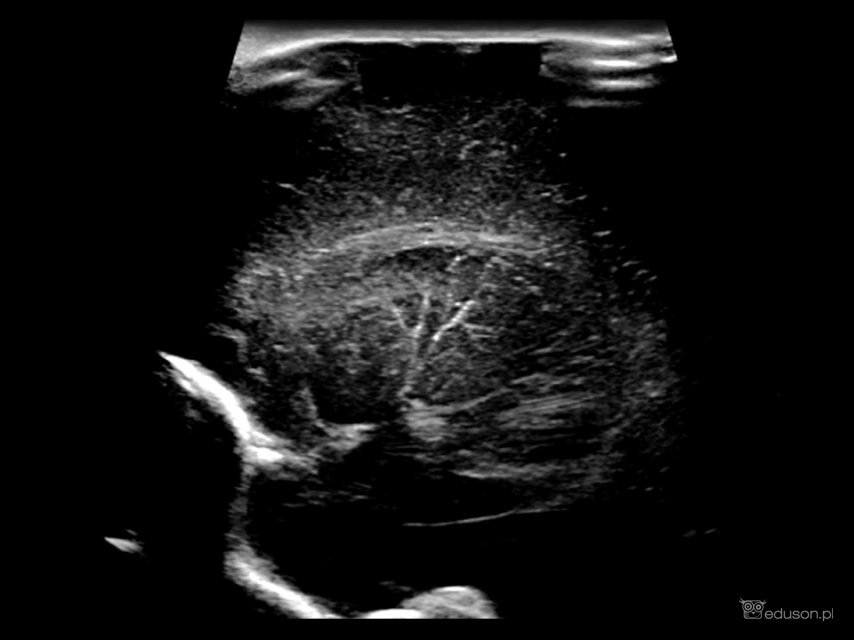
Duża różnorodność potencjalnych czynników etiologicznych sprzyjających rozwojowi waskulopatii sprawia, że należy indywidualnie podejść do jej znaczenia klinicznego. Uwidocznienie w badaniu usg zmian o charakterze waskulopatii prążkowiowo-wzgórzowej powinno skłonić do dalszej diagnostyki, zwłaszcza w sytuacji, gdy zmianom w badaniu usg towarzyszą inne objawy kliniczne. W literaturze podkreśla się, że u około 50% noworodków z infekcją CMV udaje się uwidocznić zmiany o charakterze LSV, którym często towarzyszą inne zmiany w usg mózgowia. W przypadku podejrzenia infekcji wrodzonej, poza LSV, warto zwrócić uwagę na inne zmiany możliwe do uwidocznienia w badaniu ultrasonograficznym (torbiele podwyściółkowe, zaburzenia echogeniczności istoty białej okołokomorowej, zwapnienia okołokomorowe, zmiany malacyjne, wyokrąglenie rogów przednich komór bocznych, hipoplazja móżdżku czy mikrocephalia).
Waskulopatia prążkowiowo-wzgórzowa u noworodka z infekcją CMV. W okolicy podwyściółkowej widoczne dodatkowe cechy infekcji wrodzonej pod postacią zmian płynowych przypominających kompleks torbieli, a także podwyższona echogeniczność istoty białej (grzbietowo do komory bocznej).
Nie wykazano, aby obecność waskulopatii prążkowiowo-wzgórzowej wiązała się z odległymi skutkami w rozwoju dziecka i innymi szczególnymi powikłaniami neurologicznymi, choć niektórzy autorzy zwracają uwagę na częstsze występowanie trudności w rozwoju funkcji poznawczych u dzieci, u których obserwowano cechy LSV w badaniu usg. Nie ma też określonych wytycznych co do konieczności monitorowania waskulopatii w dłuższym okresie czasu. Według niektórych autorów obecność LSV może zwiększać ryzyko zaburzeń słuchu u noworodków leczonych z powodu infekcji CMV.
Ultrasonografia jest metodą z wyboru w diagnostyce i monitorowaniu waskulopatii prążkowiowo-wzgórzowej u noworodków i niemowląt.
Zapamiętaj
1. W badaniu usg waskulopatia prążkowiowo wzgórzowa jest widoczna jako hiperechogeniczny zarys naczyń wzgórzowo-prążkowiowych i soczewkowo-prążkowiowych
2. W postępowaniu diagnostycznym, w przypadku uwidocznienia zmian o charakterze waskulopatii prążkowiowo-wzgórzowej, należy uwzględnić następujące jednostki chorobowe:
- Infekcje wrodzone z grupy TORCH (najczęściej CMV)
- Wrodzone wady serca
- Aberracje chromosomalne i inne zaburzenia genetyczne
- Choroby metaboliczne
- Niedotlenienie okołoporodowe
- Zaburzenia metaboliczne u matki w czasie ciąży (m.in. alkoholizm, narkotyki)
3. Zmiany o charakterze LSV są lepiej widoczne w badaniu usg w porównaniu z innymi metodami obrazowymi (MRI i TK)
4. Nie są znane odległe skutki związane z obecnością cech waskulopatii prążkowiowo-wzgórzowej u noworodków i niemowląt. Wydaje się, że obserwowane odległe skutki w rozwoju dziecka i ewentualne następstwa neurologiczne należy przypisać jednostkom chorobowym, w wyniku których doszło do rozwoju LSV, a nie samej waskulopatii.
Piśmiennictwo
1. Amir J, Schwarz M, Levy I, Haimi-Cohen Y, Pardo J. Is lenticulostriated vasculopathy a sign of central nervous system insult in infants with congenital CMV infection? Arch Dis Child. 2011;96(9):846-50. [Medline] [full text]
2. Coley BD, Rusin JA, Boue DR. Importance of hypoxic/ischemic conditions in the development of cerebral lenticulostriate vasculopathy. Pediatr Radiol. 2000;30(12):846–855. [Medline]
3. El Ayoubi M, de Bethmann O, Monset-Couchard M. Lenticulostriate echogenic vessels: clinical and sonographic study of 70 neonatal cases. Pediatr Radiol. 2003 Oct;33(10):697-703. [Medline]
4. Makhoul IR, Eisenstein I, Sujov P, Soudack M, Smolkin T, Tamir A, Epelman M. Neonatal lenticulostriate vasculopathy: further characterisation. Arch Dis Child Fetal Neonatal Ed. 2003;88(5):F410-4. [Medline] [full text]
5. Leijser LM, de Vries LS, Rutherford MA, Manzur AY, Groenendaal F, de Koning TJ, van der Heide-Jalving M, Cowan FM. Cranial ultrasound in metabolic disorders presenting in the neonatal period: characteristic features and comparison with MR imaging. AJNR Am J Neuroradiol. 2007;28(7):1223-31. [Medline] [full text]
6. Leijser LM, Steggerda SJ, de Bruïne FT, van Zuijlen A, van Steenis A, Walther FJ, van Wezel-Meijler G. Lenticulostriate vasculopathy in very preterm infants. Arch Dis Child Fetal Neonatal Ed. 2010;95(1):F42-6. [Medline] [full text]
7. Grant EG, Williams AL, Schellinger D, et al. Intracranial calcification in the infant and neonate: evaluation by sonography and CT. Radiology 1985;157:63–8. [Medline]